Telomeren worden wel vergeleken met de plastic uiteinden van schoenveters, omdat zij voorkomen dat chromosoom uiteinden gaan rafelen en aan elkaar plakken, waardoor de genetische informatie van een organisme zou worden vernietigd of vervormd.
Waar bevinden de telomeren zich? In de kern van een cel zijn onze genen gerangschikt langs gedraaide, dubbelstrengs moleculen van DNA, chromosomen genaamd.
Aan de uiteinden van de chromosomen bevinden zich stukken DNA die telomeren worden genoemd, die onze genetische gegevens beschermen het mogelijk maken dat cellen zich delen en enkele geheimen bevatten over hoe we ouder worden en kanker krijgen.
Toch worden de telomeren bij elke celdeling korter. Als ze te kort worden, kan de cel zich niet meer delen; hij wordt inactief of ” verouderd ” en sterft. Dit verkortingsproces wordt in verband gebracht met veroudering, kanker en een grotere kans op overlijden.
Wat zijn telomeren?
Net als de rest van een chromosoom, inclusief de genen, zijn dit reeksen DNA-ketens met een chemische code. Net als alle DNA zijn ze opgebouwd uit vier nucleïnezuurbasen: G voor guanine, A voor adenine, T voor thymine en C voor cytosine.
Ze bestaan uit herhalende reeksen van TTAGGG op de ene streng gekoppeld aan AATCCC op de andere streng. Eén deel van het telomeer is dus een “herhaling” van zes “basenparen.
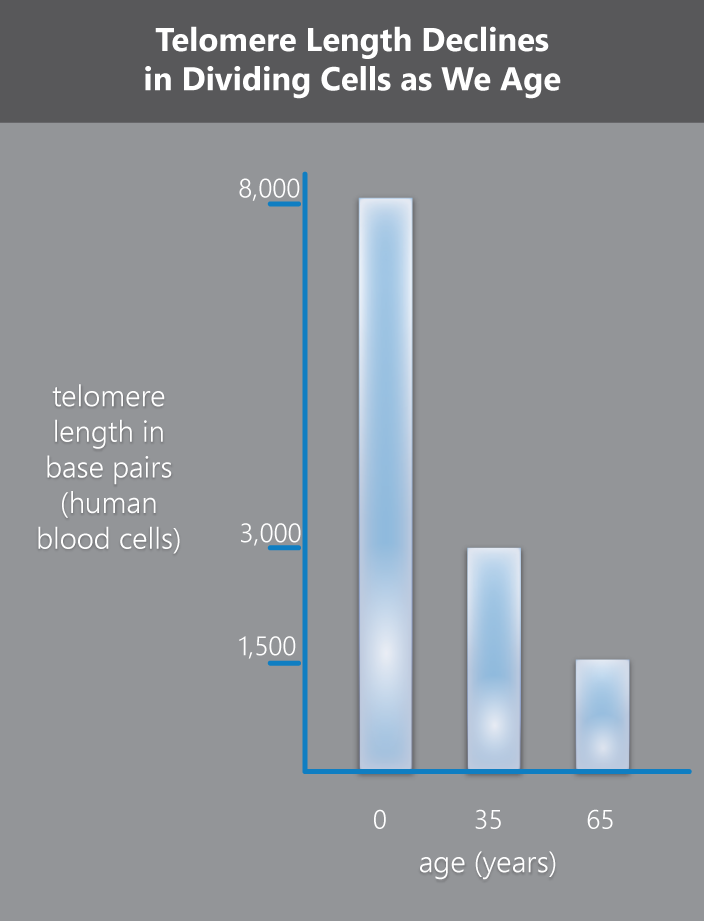
In witte bloedcellen varieert de lengte van 8.000 basenparen bij pasgeborenen tot 3.000 basenparen bij volwassenen en zo laag als 1.500 bij ouderen. (Een heel chromosoom heeft ongeveer 150 miljoen basenparen.) Bij elke deling verliest een gemiddelde cel 30 tot 200 basenparen van de uiteinden van zijn telomeren.
Cellen kunnen zich normaal gesproken maar zo’n 50 tot 70 keer delen, waarbij deze steeds korter worden totdat de cellen verouderen en afsterven.
- Telomeren worden niet korter in weefsels waar cellen zich niet voortdurend delen, zoals de hartspier.
Waarom hebben chromosomen telomeren?
Zonder telomeren zou het belangrijkste deel van het chromosoom, het deel met genen die essentieel zijn voor het leven bij elke celdeling korter worden. Ze zorgen er dus voor dat cellen zich kunnen delen zonder genen te verliezen. De celdeling is nodig voor de groei van nieuwe huid, bloed, botten en andere cellen.
 Zonder telomeren zouden chromosoom uiteinden kunnen samensmelten en de genetische blauwdruk van de cel beschadigen, wat mogelijk storingen, kanker of celdood zou kunnen veroorzaken.
Zonder telomeren zouden chromosoom uiteinden kunnen samensmelten en de genetische blauwdruk van de cel beschadigen, wat mogelijk storingen, kanker of celdood zou kunnen veroorzaken.
Omdat gebroken DNA gevaarlijk is, heeft een cel het vermogen om schade aan chromosomen op te sporen en te repareren. Zonder telomeren zouden de uiteinden van chromosomen eruit zien als gebroken DNA, en zou de cel proberen iets te repareren dat niet beschadigd was. Daardoor zouden ze ook stoppen met delen en uiteindelijk afsterven.
Waarom worden ze bij elke celdeling korter?
Voordat een cel zich kan delen, maakt hij kopieën van zijn chromosomen, zodat beide nieuwe cellen identiek genetisch materiaal hebben. Om te kunnen kopiëren, moeten de twee DNA-strengen van een chromosoom zich ontrollen en scheiden.
Een enzym (DNA polymerase) leest dan de bestaande strengen om twee nieuwe strengen te bouwen. Het begint het proces met behulp van korte stukjes RNA.
Als elke nieuwe passende streng compleet is, is hij iets korter dan de oorspronkelijke streng, vanwege de ruimte die aan het eind nodig is voor dit kleine stukje RNA. Het is als iemand die zichzelf in een hoek schildert en de hoek niet meer kan schilderen.

Telomerase gaat het verkorten van telomeren tegen
Een enzym met de naam telomerase voegt basen toe aan de uiteinden van telomeren. In jonge cellen zorgt telomerase ervoor dat deze niet te veel slijten. Maar als cellen zich herhaaldelijk delen, is er niet genoeg telomerase, zodat deze korter worden en de cellen verouderen.
Telomerase blijft actief in sperma en eieren, die van generatie op generatie worden doorgegeven. Als voortplantingscellen geen telomerase hadden om de lengte van hun telomeren op peil te houden, zou elk organisme met zulke cellen snel uitsterven.
Telomeren en kanker
Als een cel kanker begint te krijgen, deelt hij zich vaker en worden zijn ze heel kort. Als deze telomeren te kort worden, kan de cel afsterven. Vaak ontsnappen deze cellen aan de dood door meer telomerase enzym aan te maken, dat voorkomt dat de telomeren nog korter worden.
Veel kankers hebben verkorte telomeren, waaronder alvleesklier-, bot-, prostaat-, blaas-, long-, nier- en hoofd-halskanker.
Het meten van telomerase kan een manier zijn om kanker op te sporen. En als wetenschappers kunnen leren hoe ze telomerase kunnen stoppen, kunnen ze misschien kanker bestrijden door kankercellen te laten verouderen en afsterven.
Tijdens een experiment blokkeerden onderzoekers de telomerase-activiteit in menselijke borst- en prostaatkankercellen die in het laboratorium groeiden, waardoor de tumorcellen afstierven. Maar er zijn ook risico’s. Het blokkeren van telomerase zou de vruchtbaarheid, de wondgenezing en de productie van bloedcellen en cellen van het immuunsysteem kunnen schaden.
Telomeren en veroudering
Geneticus Richard Cawthon en collega’s van de Universiteit van Utah ontdekten dat kortere telomeren samenhangen met een korter leven. Bij mensen ouder dan 60 jaar hadden degenen met kortere telomeren driemaal zoveel kans om te sterven aan een hartziekte en achtmaal zoveel kans om te sterven aan een infectieziekte.
Hoewel het verkorten van telomeren in verband is gebracht met het verouderingsproces, is nog niet bekend of kortere telomeren slechts een teken van veroudering zijn, zoals grijs haar, of daadwerkelijk bijdragen aan veroudering.
Als telomerase kankercellen onsterfelijk maakt, zou het dan kunnen voorkomen dat normale cellen verouderen? Zouden we de levensduur kunnen verlengen door de lengte van telomeren te behouden of te herstellen met telomerase? Zo ja, zou dat onze kans op het krijgen van kanker vergroten?
Wetenschappers weten het nog niet zeker. Maar ze hebben telomerase in het lab kunnen gebruiken om menselijke cellen ver voorbij hun normale grens te laten delen en de cellen werden niet kankerverwekkend.
Als we telomerase zouden gebruiken om menselijke cellen “onsterfelijk” te maken, zouden we misschien massaal cellen kunnen produceren voor transplantatie. Waaronder insulineproducerende cellen om diabetes te genezen, spiercellen om spierdystrofie te behandelen, kraakbeencellen voor bepaalde soorten artritis, en huidcellen om ernstige brandwonden en wonden te genezen.
Een onbeperkte voorraad in het laboratorium gekweekte normale menselijke cellen zou ook helpen bij het testen van nieuwe medicijnen en gentherapieën.
Hoe groot is de rol bij veroudering?
Sommige langlevende soorten zoals de mens hebben telomeren die veel korter zijn dan bijvoorbeeld diersoorten als muizen, die maar een paar jaar leven. Niemand weet waarom. Maar het is een bewijs dat ze op zich niet de levensduur dicteren.
Uit de studie van Cawthon bleek dat wanneer mensen op basis van telomeerlengte in twee groepen worden verdeeld, de helft met langere telomeren gemiddeld vijf jaar langer leeft dan degenen met kortere. Deze studie suggereert dat de levensduur vijf jaar kan worden verlengd door de lengte van de telomeren bij mensen met kortere te vergroten.
Mensen met langere telomeren ervaren nog steeds een verkorting van de telomeren naarmate ze ouder worden. Hoeveel jaar zou er aan onze levensduur kunnen worden toegevoegd door het volledig stoppen van telomeerverkorting? Cawthon denkt 10 jaar en misschien 30 jaar.
Na de leeftijd van 60 jaar verdubbelt het risico op overlijden elke 8 jaar. Een 68-jarige heeft dus tweemaal zoveel kans om binnen een jaar te sterven als een 60-jarige. De studie van Cawthon vond dat verschillen in telomeerlengte slechts 4% van dat verschil uitmaken.
En hoewel de intuïtie ons vertelt dat oudere mensen een grotere kans op overlijden hebben, is slechts 6% puur te wijten aan chronologische leeftijd. Als telomeerlengte, chronologische leeftijd en geslacht worden gecombineerd (vrouwen leven langer dan mannen), zijn die factoren goed voor 37% van de variatie in het risico om boven de 60 te sterven. Wat veroorzaakt dan de andere 63%?
Een belangrijke oorzaak van veroudering is “oxidatieve stress”. Dat is de schade aan DNA, eiwitten en lipiden (vetten) veroorzaakt door oxidanten, dat zijn zeer reactieve stoffen die zuurstof bevatten.
Deze oxidanten worden normaal geproduceerd als we ademen, en zijn ook het gevolg van ontstekingen, infecties en het gebruik van alcohol en sigaretten. In een onderzoek stelden wetenschappers wormen bloot aan twee stoffen die oxidanten neutraliseren, en de levensduur van de wormen nam gemiddeld met 44% toe.
Een andere factor bij veroudering is “glycatie”. Dat gebeurt wanneer glucose, de belangrijkste suiker die we als energie gebruiken, zich bindt aan sommige van ons DNA, eiwitten en lipiden, waardoor ze hun werk niet meer kunnen doen. Het probleem wordt erger naarmate we ouder worden, waardoor lichaamsweefsels slecht gaan functioneren, wat leidt tot ziekte en dood. Glycatie kan verklaren waarom studies bij proefdieren aangeven dat beperking van de calorie-inname de levensduur verlengt.
Waarschijnlijk werken oxidatieve stress, glycatie, telomeerverkorting en chronologische leeftijd samen met verschillende genen om veroudering te veroorzaken.

Telomeren en andere ziekten
Mensen met een ziekte genaamd dyskeratosis congenita hebben telomeren die veel sneller dan normaal kort worden. Deze mensen krijgen te maken met vroegtijdige veroudering en dood. Ze lopen een groter risico op levensbedreigende infecties, leukemie en andere vormen van bloedkanker, darmaandoeningen, levercirrose en longfibrose, een dodelijke verstijving van het longweefsel.
Ze hebben ook meer kans op grijs haar, kaalheid, slechte wondgenezing, vlekken op de huid, darmaandoeningen, verweking van de botten en leerproblemen. De implicatie is dat ze een rol kunnen spelen bij al die aandoeningen, omdat het gaat om weefsels waarin cellen zich vaak delen. Er zijn ook aanwijzingen dat verkorte telomeren verband houden met de ziekte van Alzheimer, aderverkalking, hoge bloeddruk en diabetes type 2.
Wat zijn de vooruitzichten voor menselijke onsterfelijkheid?
De menselijke levensduur is aanzienlijk toegenomen sinds de jaren 1600, toen de gemiddelde levensduur 30 jaar bedroeg. In 2012 was de gemiddelde levensverwachting in de VS bijna 79.
Redenen voor de toename zijn onder meer rioleringen en andere sanitaire maatregelen, antibiotica, schoon water, koeling, vaccins en andere medische inspanningen om te voorkomen dat kinderen en baby’s sterven, verbeterde diëten en betere gezondheidszorg.
Sommige wetenschappers voorspellen dat de gemiddelde levensverwachting zal blijven stijgen, hoewel velen betwijfelen of het gemiddelde ooit veel hoger dan 90 zal worden. Maar enkelen zeggen dat een veel langere levensduur mogelijk is.
Cawthon zegt dat als alle processen van veroudering zouden kunnen worden geëlimineerd en schade door oxidatieve stress zou kunnen worden hersteld, “een schatting is dat mensen 1000 jaar zouden kunnen leven.”
Ook lezen:
Veelgestelde Vragen
Wat zijn telomeren?
Telomeren zijn herhalende DNA-sequenties aan de uiteinden van chromosomen die genetische gegevens beschermen en celdeling mogelijk maken.
Waar bevinden de telomeren zich?
Telomeren bevinden zich aan de uiteinden van chromosomen in de kern van een cel, waar onze genen zijn gerangschikt.
Waarom worden telomeren korter bij elke celdeling?
Telomeren worden korter bij elke celdeling omdat DNA-polymerase niet in staat is om de uiteinden van DNA-strengen volledig te kopiëren, wat leidt tot verkorting.
Wat is de rol van telomerase bij telomeren?
Telomerase is een enzym dat basen toevoegt aan de uiteinden van telomeren, wat helpt om hun verkorting te vertragen en celdood te voorkomen.
Hoe zijn telomeren gerelateerd aan kanker?
Kankercellen produceren vaak meer telomerase, waardoor hun telomeren langer blijven en de cellen zich ongecontroleerd kunnen blijven delen.













